kategorier: Utvalgte artikler » Begynnerelektrikere
Antall visninger: 52646
Kommentarer til artikkelen: 4
Transistorer. Del 2. Ledere, isolatorer og halvledere
Artikkelens begynnelse: Transistor historie, Transistorer: formål, enhet og prinsipper for drift
 I elektroteknikk brukes forskjellige materialer. De elektriske egenskapene til stoffer bestemmes av antall elektroner i den ytre valensbanen. Jo færre elektroner er i denne bane, jo svakere de er assosiert med kjernen, jo lettere kan de gå for å reise.
I elektroteknikk brukes forskjellige materialer. De elektriske egenskapene til stoffer bestemmes av antall elektroner i den ytre valensbanen. Jo færre elektroner er i denne bane, jo svakere de er assosiert med kjernen, jo lettere kan de gå for å reise.
Under påvirkning av temperatursvingninger bryter elektronene seg bort fra atomet og beveger seg i det interatomiske rommet. Slike elektroner kalles fri, og de skaper en elektrisk strøm i lederne. Er det et stort interatomisk rom, er det rom for frie elektroner å reise inne i materien?
Strukturen til faste stoffer og væsker virker kontinuerlig og tett, noe som minner om strukturen til en trådkule. Men faktisk er til og med faste stoffer mer som et fiske- eller volleyballnett. Selvfølgelig kan ikke dette skjelnes på husholdningsnivå, men det er fastslått av nøyaktige vitenskapelige studier at avstandene mellom elektronene og atomkjernen er mye større enn deres egne dimensjoner.
Hvis størrelsen på atomkjernen er representert i form av en ball på størrelse med en fotballkule, vil elektronene i denne modellen være på størrelse med en ert, og hver slik er er lokalisert fra "kjernen" i en avstand på flere hundre og til og med tusenvis av meter. Og mellom kjernen og elektronet er tomhet - det er rett og slett ingenting! Hvis vi forestiller oss avstandene mellom stoffets atomer i samme skala, vil dimensjonene i det hele tatt vise seg å være fantastiske - titalls og hundrevis av kilometer!
Gode ledere av strøm er metaller. For eksempel har atomene i gull og sølv bare ett elektron i den ytre bane, derfor er de de beste lederne. Jern leder også strøm, men litt verre.
Led strøm enda verre legeringer med høy motstand. Dette er nichrome, manganin, constantan, fechral og andre. En slik rekke legeringer med høy motstand er på grunn av det faktum at de er designet for å løse forskjellige problemer: varmeelementer, strekkmålere, referansemotstander for måleinstrumenter og mye mer.
For å evaluere et materials evne til å lede strøm, er begrepet "Elektrisk ledningsevne". Returverdien er resistivitet. I mekanikk tilsvarer disse konseptene den spesifikke tyngdekraften.
isolatorer, i motsetning til ledere, er ikke tilbøyelig til å miste elektroner. Bindingen mellom elektronet og kjernen er veldig sterk i dem, og det er nesten ingen frie elektroner. Mer presist, men veldig få. Samtidig er det i noen isolatorer flere av dem, og isolasjonskvaliteten deres er følgelig verre. Det er nok å sammenligne for eksempel keramikk og papir. Derfor kan isolatorer betinget deles inn på godt og vondt.
Utseendet til frie ladninger selv i isolatorer skyldes termiske vibrasjoner av elektroner: under påvirkning av høy temperatur forverres isolasjonsegenskapene, og noen elektroner klarer fremdeles å bryte vekk fra kjernen.
Tilsvarende ville resistiviteten til en ideell leder være null. Men heldigvis er det ingen slik dirigent: forestill deg hvordan Ohms lov ((I = U / R) ville se ut med null i nevneren !!! Farvel til matematikk og elektroteknikk.
Og bare ved en absolutt null temperatur (-273,2 ° C) stopper de termiske svingningene helt, og den verste isolatoren blir god nok. For å bestemme numerisk "dette" er dårlig - bruk gjerne resistivitetsbegrepet. Dette er motstanden i ohm av en kube med en kantlengde på 1 cm, dimensjonen på motstand oppnås i ohm / cm. Den spesifikke resistensen til noen stoffer er vist nedenfor.Konduktivitet er gjensidigheten til resistiviteten, er måleenheten til Siemens, - 1Sm = 1 / Ohm.
De har god ledningsevne eller lav motstand: sølv 1,5 * 10 ^ (- 6), les hvordan (halvannen til ti til effekten minus seks), kobber 1,78 * 10 ^ (- 6), aluminium 2,8 * 10 ^ (- 6). Konduktiviteten til legeringer med høy motstand er mye verre: konstant 0,5 * 10 ^ (- 4), nichrom 1,1 * 10 ^ (- 4). Disse legeringene kan kalles dårlige ledere. Etter alle disse komplekse tallene, erstatt Ohm / cm.
I en egen gruppe kan halvledere også skilles: germanium 60 Ohm / cm, silisium 5000 Ohm / cm, selen 100 000 Ohm / cm. Resistiviteten til denne gruppen er større enn for dårlige ledere, men mindre enn for dårlige isolatorer, for ikke å snakke om gode. Antagelig, med samme suksess, kunne halvledere bli kalt halvisolatorer.
Etter en så kort kjennskap til strukturen og egenskapene til et atom, bør man vurdere hvordan atomer interagerer med hverandre, hvordan atomer interagerer med hverandre, hvordan molekyler er laget av dem, fra hvilke forskjellige stoffer er sammensatt. For å gjøre dette, må du igjen huske elektronene i atomens ytre bane. Det er jo de som deltar i bindingen av atomer til molekyler og bestemmer de fysiske og kjemiske egenskapene til materie.
Hvordan atomer er laget av atomer
Ethvert atom er i en stabil tilstand hvis det er 8 elektroner i dens ytre bane. Han søker ikke å ta elektroner fra nabolandet atomer, men han gir ikke opp sine egne. For å bekrefte dette er det nok i periodiske tabeller å se på inerte gasser: neon, argon, krypton, xenon. Hver av dem har 8 elektroner i den ytre bane, noe som forklarer motviljen til disse gassene til å inngå noen relasjoner (kjemiske reaksjoner) med andre atomer for å bygge molekyler med kjemikalier.
Situasjonen er helt annerledes for atomene som ikke har 8 dyrebare elektroner i sin ytre bane. Slike atomer foretrekker å forene seg med andre for å supplere sin ytre bane med opptil 8 elektroner og finne en rolig stabil tilstand.
For eksempel det velkjente vannmolekylet H2O. Det består av to hydrogenatomer og ett oksygenatom, som vist på figuren. 1.
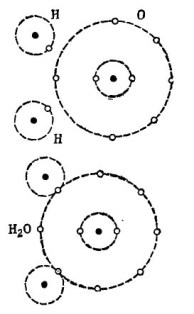
bilde 1. Hvordan et vannmolekyl skapes.
I den øvre delen av figuren er to hydrogenatomer og ett oksygenatom vist separat. Det er 6 elektroner i den ytre bane av oksygen og to elektroner ved to hydrogenatomer er i nærheten. Oksygen inntil det kjære nummer 8 mangler bare to elektroner i den ytre bane, som han vil motta ved å legge to hydrogenatomer til seg selv.
Hvert hydrogenatom for fullstendig lykke mangler 7 elektroner i den ytre bane. Det første hydrogenatom får i sin ytre bane 6 elektroner fra oksygen og et annet elektron fra dets tvilling - det andre hydrogenatom. Det er nå 8 elektroner i den ytre bane med elektronet. Det andre hydrogenatom fullfører også sin ytre bane til det ettertraktede tallet 8. Denne prosessen er vist i den nedre delen av figuren. 1.
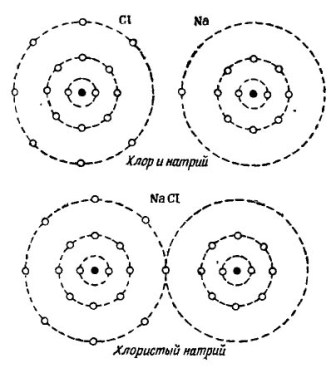
På bildet 2 Prosessen med å kombinere natrium- og kloratomer er vist. Resultatet er natriumklorid, som selges i butikker som kalles salt.
bilde 2. Prosessen med å kombinere natrium og kloratomer
Også her mottar hver av deltakerne det manglende antallet elektroner fra den andre: klor fester et enkelt natriumelektron til sine syv elektroner, mens det gir atomene til natriumatom. Begge atomene i den ytre bane har 8 elektroner, og det er her full enighet og velstand oppnås.
Valens av atomer
Atomer med 6 eller 7 elektroner i sin ytre bane pleier å feste 1 eller 2 elektroner til seg selv. De sier om slike atomer at de er ett eller toverdige. Men hvis i den ytre bane til et atom 1, 2 eller 3 elektroner, har en slik atom en tendens til å gi dem bort. I dette tilfellet regnes atomet som ett, to eller trivalent.
Hvis det er 4 elektroner i den ytre bane til et atom, foretrekker et slikt atom å kombinere med det samme, som også har 4 elektroner. Slik kombineres germanium og silisiumatomer som brukes i produksjonen av transistorer. I dette tilfellet kalles atomene tetravalente. (Atomene i germanium eller silisium kan kombineres med andre elementer, for eksempel oksygen eller hydrogen, men disse forbindelsene er ikke interessante i vår historie.)
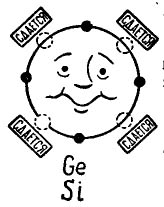
På bildet 3 vises et germanium- eller silisiumatom som ønsker å kombinere med det samme atom. Små sorte sirkler er atomets egne elektroner, og lyssirkler indikerer stedene der elektronene til de fire atomene - naboer - faller.
bilde 3. Germaniumatom (silisium).
Krystallstrukturen til halvledere
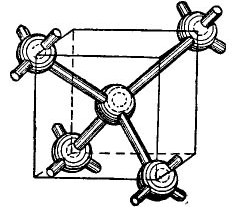
Atomene til germanium og silisium i den periodiske tabellen er i samme gruppe med karbon (den kjemiske formelen til diamant C er ganske enkelt store karbonkrystaller oppnådd under visse betingelser), og danner derfor, når de kombineres, en diamantlignende krystallstruktur. Dannelsen av en slik struktur er vist, i en forenklet, selvfølgelig form i figuren 4.
bilde 4.
I midten av kuben er et germaniumatom, og 4 flere atomer er plassert i hjørnene. Atomet som er avbildet i midten av kuben er bundet av dens valenselektroner til sine nærmeste naboer. I sin tur gir de kantete atomene sine valenselektroner til atomet som ligger i midten av kuben og dens naboer - atomer som ikke er vist på figuren. Dermed blir de ytre banene supplert med opptil åtte elektroner. Selvfølgelig er det ingen kube i krystallgitteret, det er bare vist på figuren slik at det gjensidige, volumetriske arrangementet av atomer er tydelig.
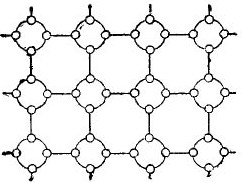
Men for å forenkle historien om halvledere så mye som mulig, kan krystallgitteret avbildes som en flat skjematisk tegning, til tross for at de interatomiske bindingene likevel er plassert i verdensrommet. En slik krets er vist på figuren. 5.
bilde 5. Germanium krystallgitteret i flat form.
I en slik krystall er alle elektronene godt festet til atomene ved deres valensbindinger, derfor er det tilsynelatende ganske enkelt ingen frie elektroner her. Det viser seg at foran oss er en isolator i figuren, siden det ikke er gratis elektroner i den. Men dette er faktisk ikke slik.
Intrinsic konduktivitet
Faktum er at under påvirkning av temperatur klarer noen elektroner fortsatt å bryte seg vekk fra atomene sine, og i noen tid befri seg fra bindingen med kjernen. Derfor eksisterer en liten mengde frie elektroner i en germaniumkrystall som det er mulig å lede en elektrisk strøm. Hvor mange gratis elektroner finnes i en germaniumkrystall under normale forhold?
Det er ikke mer enn to slike gratiselektroner per 10 ^ 10 (ti milliarder) atomer, så germanium er en dårlig leder, eller som det er vanlig å si en halvleder. Det skal bemerkes at bare ett gram germanium inneholder 10 ^ 22 (ti tusen milliarder milliarder) atomer, som lar deg "få" omtrent to tusen milliarder gratis elektron. Det ser ut til at nok til å passere en stor elektrisk strøm. For å håndtere dette problemet er det nok å huske hva strømmen på 1 A.
En strøm på 1 A tilsvarer å passere gjennom en leder på ett sekund en elektrisk ladning på 1 Coulomb, eller 6 * 10 ^ 18 (seks milliarder milliarder) elektroner per sekund. På denne bakgrunn er det usannsynlig at to tusen milliarder gratiselektroner, og til og med spredt over en enorm krystall, vil sikre passering av høye strømmer. Selv om det på grunn av termisk bevegelse eksisterer liten ledningsevne i Tyskland. Dette er den såkalte egenkonduktiviteten.
Elektronisk og hullledningsevne
Når temperaturen stiger, overføres ekstra energi til elektronene, deres termiske vibrasjoner blir mer energiske, som et resultat av at noen elektroner klarer å bryte bort fra atomene sine.Disse elektronene blir frie, og i mangel av et eksternt elektrisk felt, gjør de kaotiske bevegelser og beveger seg i ledig rom.
Atomer som har mistet elektroner kan ikke foreta tilfeldige bevegelser, men bare svinge i forhold til deres normale stilling i krystallgitteret. Slike atomer, som har mistet elektroner, kalles positive ioner. Vi kan anta at i stedet for elektroner revet fra atomene deres, oppnås frie rom, som ofte kalles hull.
Generelt er antallet elektron og hull det samme, slik at et hull kan fange et elektron som er i nærheten. Som et resultat blir et atom fra et positivt ion igjen nøytralt. Prosessen med å kombinere elektroner med hull kalles rekombinasjon.
På samme frekvens skilles elektroner fra atomer, derfor er antallet elektroner og hull for en bestemt halvleder i gjennomsnitt lik, konstant og avhengig av ytre forhold, spesielt temperatur.
Hvis en spenning tilføres halvlederkrystallen, vil elektronbevegelsen bli bestilt, en strøm vil strømme gjennom krystallen på grunn av dens elektron- og hullledningsevne. Denne konduktiviteten kalles iboende, den ble allerede nevnt litt høyere.
Men rene halvledere med elektronisk og hullkonduktivitet er uegnet for fremstilling av dioder, transistorer og andre detaljer, siden grunnlaget for disse enhetene er p-n (les “pe-en”) krysset.
For å oppnå en slik overgang er det behov for to typer halvledere, to typer konduktivitet (p - positiv - positiv, hull) og (n - negativ - negativ, elektronisk). Disse typer halvledere oppnås ved doping, tilsetning av urenheter til rene germanium- eller silisiumkrystaller.
Selv om mengden urenheter er veldig liten, endrer deres tilstedeværelse i stor grad egenskapene til halvlederen, slik at du kan få halvledere med forskjellig konduktivitet. Dette vil bli diskutert i neste del av artikkelen.
Boris Aladyshkin, electro-no.tomathouse.com
Se også på elektrohomepro.com
: