kategorier: Begynnerelektrikere, Industriell elektriker
Antall visninger: 37528
Kommentarer til artikkelen: 0
Den praktiske anvendelsen av elektrolyse
Når en elektrisk strøm går gjennom en løsning eller en smelte av elektrolytt, frigjøres oppløste stoffer eller andre stoffer som er produkter av sekundære reaksjoner på elektrodene på elektrodene. Denne fysisk-kjemiske prosessen kalles elektrolyse.
Essensen av elektrolyse
I det elektriske feltet som er laget av elektrodene, kommer ionene i ledende væske i en ordnet bevegelse. Den negative elektroden er katoden, den positive er anoden.
Negative ioner kalt anioner (ioner av hydroksylgruppen og syre-rester) skynder seg til anoden, og positive ioner som kalles kationer (hydrogen, metall, ammoniumioner, etc.) skynder seg til katoden
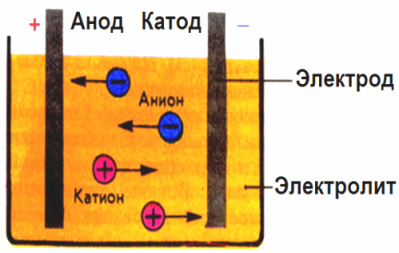
En oksidasjonsreduksjonsprosess foregår ved elektrodene: elektrokjemisk reduksjon av partikler (atomer, molekyler, kationer) skjer ved katoden, og elektrokjemisk oksidasjon av partikler (atomer, molekyler, anioner) skjer ved anoden. Dissosieringsreaksjoner i en elektrolytt er primære reaksjoner, og reaksjoner som går direkte ved elektrodene kalles sekundære.
Lovene til Faraday elektrolyse
Separasjonen av elektrolysereaksjoner i primær og sekundær hjalp Michael Faraday med å etablere lovene om elektrolyse:
-
Den første loven om Faraday-elektrolyse: massen av stoffet som er avsatt på elektroden under elektrolyse er direkte proporsjonalt med mengden elektrisitet som overføres til denne elektroden. Med elektrisitetsmengde menes en elektrisk ladning, målt som regel i anheng.
-
Den andre loven om Faraday-elektrolyse: for en gitt mengde strøm (elektrisk ladning) er massen til et kjemisk element som er avsatt på elektroden direkte proporsjonal med den ekvivalente massen til elementet. Ekvivalentmassen til et stoff er dens molmasse delt med et helt tall, avhengig av den kjemiske reaksjonen stoffet er involvert i.
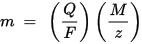
m er massen til stoffet som er avsatt på elektroden, Q er den totale elektriske ladning som går gjennom stoffet F = 96 485,33 (83) C mol - 1 er Faraday-konstanten, M er molens masse av stoffet (For eksempel den molære massen av vann H2O = 18 g / mol), z er valens antall ioner av et stoff (antall elektroner per ion).
Merk at M / z er den ekvivalente massen til det utfelte stoffet. For den første Faraday-loven er M, F og z konstanter, så jo større verdien av Q, desto større er verdien av m. For den andre Faraday-loven er Q, F og z konstanter, så jo større verdien av M / z (ekvivalent masse), desto større er verdien av m.
Elektrolyse er mye brukt i dag i industri og teknologi. For eksempel er det elektrolyse som fungerer som en av de mest effektive metodene for industriell produksjon av hydrogen, hydrogenperoksyd, mangandioksid, aluminium, natrium, magnesium, kalsium og andre stoffer. Elektrolyse brukes til å behandle avløpsvann, i galvanisering, elektroplettering og til slutt i kjemiske strømkilder. Men først ting først.
Innhenting av rene metaller fra malm ved elektrolyse
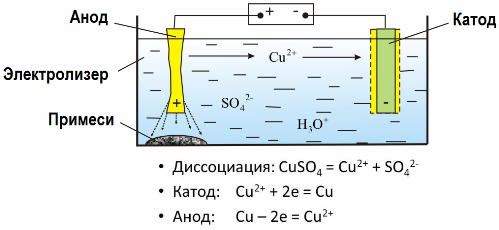
Takket være elektrolyse blir mange metaller trukket ut fra malm og utsatt for videre behandling. Så når malm eller anriket malm - konsentrat - behandles med reagenser, føres metallet inn i løsningen, og deretter, ved elektroekstraksjon, isoleres metallet fra løsningen. Rent metall frigjøres samtidig ved katoden. På denne måten motta sink, kobber, kadmium.
Metaller underkastes elektrondefinisjon for å eliminere urenheter og for å konvertere de inneholdte urenheter til en form som er praktisk for videre bearbeiding. Metallet som skal rengjøres støpes i form av plater, og disse platene brukes som anoder i elektrolyse.
Når strømmen går, løses metall av anoden, passerer i form av kationer inn i løsningen, deretter blir kationene utladet ved katoden og danner et bunnfall av rent metall. Forurensningene til anoden løses ikke opp - de utfeller med anodeslam, eller passerer inn i elektrolytten, hvorfra de kontinuerlig eller periodisk fjernes.
Tenk som et eksempel kobberelektrefinisjon. Hovedkomponenten i løsningen - kobbersulfat - det vanligste og billigste saltet av dette metallet. Løsningen har lav elektrisk ledningsevne. For å øke den tilsettes svovelsyre til elektrolytten.
I tillegg blir små mengder tilsetningsstoffer ført inn i løsningen for å lette dannelsen av et kompakt metallbunnfall. Generelt blir kobber, nikkel, bly, tinn, sølv og gull utsatt for elektrolytisk raffinering.
Elektrolyse Behandling av avløpsvann
Elektrolyse brukes i rensing av avløpsvann (prosesser med elektrokoagulering, elektroekstraksjon og elektroflotasjon). Den elektrokjemiske rengjøringsmetoden er en av de mest brukte. For elektrolyse brukes uoppløselige anoder (magnetitt, blyoksyd, grafitt, mangan, som er avsatt på en titanbase), eller løselig (aluminium, jern).
Denne metoden brukes til å isolere giftige organiske og uorganiske stoffer fra vann. For eksempel renses kobberrør i skala med en løsning av svovelsyre, og industrielt avløpsvann må deretter rengjøres ved elektrolyse med en uoppløselig anode. Kobber frigjøres ved katoden, som igjen kan brukes i samme foretak.
Alkalisk avløpsvann renses ved elektrolyse fra cyanidforbindelser. For å akselerere oksidasjonen av cyanider, øke den elektriske ledningsevnen og spare energi, brukes et tilsetningsstoff i form av natriumklorid i vann.
Elektrolyse utføres med en grafittanode og en stålkatode. Cyanider ødelegges under elektrokjemisk oksidasjon og klor, som frigjøres på anoden. Effektiviteten av slik rengjøring er nær 100%.
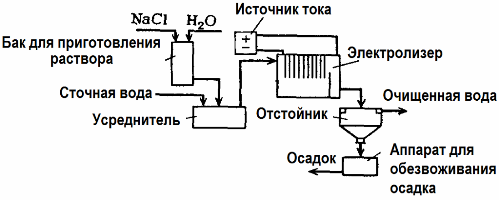
I tillegg til direkte elektrokjemisk rengjøring, kan det inkluderes i elektrolyseprosessen koagulasjon. Bortsett fra tilsetning av salter, blir elektrolyse utført med løselig aluminium eller jernanoder. Da blir ikke bare forurensningene på anoden ødelagt, men selve anoden løses opp. Aktive dispergerte forbindelser dannes som koagulerer (tykner) kolloidale spredte forurensninger.
Denne metoden er effektiv i behandlingen av avløpsvann fra fett, oljeprodukter, fargestoffer, oljer, radioaktive stoffer, etc. Det kalles elektrokoagulering.
galvanisering
Elektroplettering er elektrolytisk avsetning av visse metaller for å beskytte produkter mot korrosjon og for å gi dem et passende estetisk utseende (belegg er laget med krom, nikkel, sølv, gull, platina, etc.). Tingen blir grundig rengjort, avfettet og brukt som en katode i et elektrolytisk bad der en saltløsning av metallet som det er nødvendig å belegge produktet med helles.
En plate av samme metall brukes som anoden. Som regel brukes et par anodeplater, og emnet som skal galvaniseres plasseres mellom dem.
galvanoplastics
Elektroplettering - avsetning av metall på overflaten av forskjellige kropper for å reprodusere sine former: former for støping av deler, skulpturer, trykte klisjeer, etc.

Galvanisk avsetning av metall på overflaten av et objekt er bare mulig når denne overflaten eller hele gjenstanden er en elektrisk strømleder, så det anbefales å bruke metaller til å lage modeller eller former. Smeltbare metaller er best egnet for dette formålet: bly, tinn, selgere, trelegering.
Disse metallene er myke, lett bearbeidede med metallverktøy, er godt gravert og støpt. Etter å ha bygget opp det galvaniske laget og etterbehandlet smeltes formmetallet fra det ferdige produktet.
Imidlertid er de største mulighetene for fremstilling av modeller fortsatt representert av dielektriske materialer. For å metallisere slike modeller er det nødvendig å gi overflaten sin elektrisk ledningsevne. Suksess eller fiasko avhenger til slutt hovedsakelig av kvaliteten på det ledende laget. Dette laget kan påføres på en av tre måter.
Den vanligste måten er grafitirovanie, den er egnet for modeller av plasticine og andre materialer som tillater sliping av grafitt på overflaten.
Det neste trikset er bronzing, er metoden god for modeller med relativt sammensatt form, for forskjellige materialer, men på grunn av tykkelsen på bronselaget er overføringen av små deler noe forvrengt.
Og til slutt forsølegnet i alle tilfeller, men spesielt uunnværlig for skjøre modeller med en veldig kompleks form - planter, insekter, etc.
Kjemiske strømkilder
Elektrolyse er også hovedprosessen som de mest avanserte kjemiske strømkildene, som batterier og akkumulatorer, fungerer på. Det er to elektroder i kontakt med elektrolytten.
En potensiell forskjell er etablert mellom elektrodene - en elektromotorisk kraft som tilsvarer den frie energien til redoksreaksjonen. Se her for mer informasjon: Kjemiske kilder til elektrisk strøm
Sitronbatteri (klikk på bildet for å forstørre)
Virkningen av kjemiske strømkilder er basert på forekomsten av romlig atskilte prosesser med en lukket ekstern krets: på den negative anoden oksideres reduksjonsmidlet, de frie elektronene som dannes passerer gjennom den eksterne kretsen til den positive katoden, og skaper en utladningsstrøm, hvor de deltar i oksidasjonsreduksjonsreaksjonen. Således går strømmen av negativt ladede elektroner langs den eksterne kretsen fra anoden til katoden, det vil si fra den negative elektroden til den positive.
Se også på elektrohomepro.com
: