kategorier: Utvalgte artikler » Begynnerelektrikere
Antall visninger: 36288
Kommentarer til artikkelen: 1
Kjemiske strømkilder: hovedegenskaper
 I mer enn to århundrer har menneskeheten brukt energien fra kjemiske reaksjoner mellom forskjellige stoffer for å produsere likestrøm.
I mer enn to århundrer har menneskeheten brukt energien fra kjemiske reaksjoner mellom forskjellige stoffer for å produsere likestrøm.
Arbeidsprinsipp
Redoksreaksjonen som oppstår mellom stoffer med egenskapene til et oksidasjonsmiddel og et reduksjonsmiddel ledsages av frigjøring av elektroner, hvis bevegelse danner en elektrisk strøm. For å bruke energien er det imidlertid nødvendig å skape betingelser for passering av elektroner gjennom en ekstern krets, ellers frigjøres den av varme fra en enkel blanding av et oksidasjonsmiddel og et reduksjonsmiddel.
Derfor har alle kjemiske strømkilder to elektroder:
-
anoden som oksidasjon skjer på;
-
katode, som utfører restaurering av stoffet.
Elektroder på avstand plasseres i et kar med en elektrolytt - et stoff som leder elektrisk strøm på grunn av prosessene med dissosiasjon av mediet til ioner.
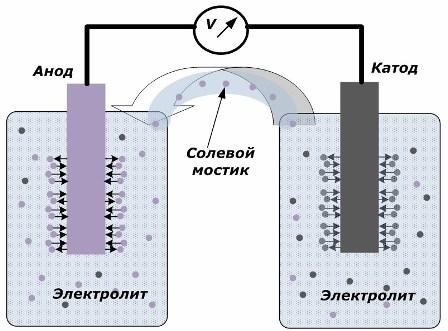
Prinsippet for å konvertere kjemisk energi til elektrisk energi
Figuren viser at elektrodene er plassert i separate fartøyer forbundet med en salt bro gjennom hvilken bevegelsen av ioner langs den indre kretsen skapes. Når de ytre og indre kretser er åpne, oppstår to prosesser på elektrodene: overgangen til ioner fra metallet fra elektroden til elektrolytten og overgangen av ioner fra elektrolytten til krystallgitteret til elektrodene.
Strømningshastighetene for disse prosessene er de samme, og spenningspotensialene til motsatte tegn akkumuleres på hver elektrode. Hvis de er koblet gjennom en saltbro og det påføres en belastning, vil det oppstå en elektrisk krets. En indre strøm genereres ved bevegelse av ioner mellom elektrodene gjennom elektrolytten og saltbroen. Bevegelsen av elektroner langs den eksterne kretsen i retningen fra anoden til katoden.
Nesten alle redoksreaksjoner ledsages av elektrisitetsproduksjon. Men verdien avhenger av mange faktorer, inkludert volumene og massene av kjemikaliene som brukes, materialene som brukes til å lage elektrodene, for eksempel elektrolytt, ionkonsentrasjon, design.
De mest brukte i moderne kjemiske strømkilder er:
-
for materialet til anoden (reduksjonsmiddel), sink (Zn), bly (Pb), kadmium (Cd) og noen andre metaller;
-
for katodematerialet (oksydasjonsmiddel) - blyoksyd PbO2, manganoksid MnO2, nikkelhydroksyd NiOOH og andre;
-
elektrolytter basert på oppløsninger av syrer, alkalier eller salter.
Klassifiseringsmetoder
Den ene delen av kjemiske kraftkilder kan gjenbrukes, mens den andre ikke kan. Dette prinsippet tas som grunnlag for klassifiseringen av dem.
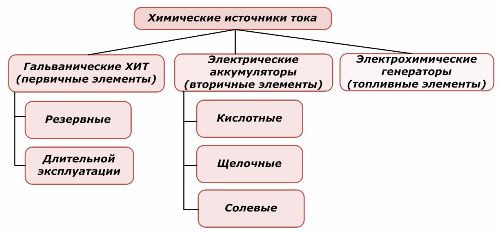
Klassifisering av kjemiske elementer
Elektromotorisk kraft galvaniske celleravhengig av design, når 1,2 ÷ 1,5 volt. For å oppnå store verdier, blir de kombinert i batterier og koblet i serie. Når batteriene er koblet parallelt, øker strømmen og effekten.
Det er generelt akseptert at primære kjemiske strømkilder ikke støtter oppladning, selv om mer nøyaktig denne posisjonen kan formuleres annerledes: implementeringen er ikke økonomisk gjennomførbar.
Redundante primære kjemiske strømkilder lagres i en tilstand der elektrolytten er isolert fra elektrodene. Dette eliminerer forekomsten av redoksreaksjonen og sikrer klar for igangkjøring. De gjenbrukes ikke. Holdbarheten for kjemiske sikkerhetskopieringskilder er begrenset til 10–15 år.
Batteriene lades opp ved bruk av ekstern elektrisk energi. På grunn av denne funksjonen kalles de sekundære strømkilder. De tåler hundrevis og tusenvis av ladning-utladningssykluser.Batteriets EMF kan ligge i området 1,0 ÷ 1,5 volt. De kombineres også til batterier.
Elektrokjemiske generatorer arbeider etter prinsippet om galvaniske celler, men for å utføre den elektrokjemiske reaksjonen, kommer stoffer utenfra, og alle frigjorte produkter fjernes fra elektrolytten. Dette lar deg organisere en kontinuerlig prosess.
Viktige ytelsesegenskaper for kjemiske kraftkilder
1. Spenningen over åpne terminaler
Avhengig av design, kan en enkelt kilde bare skape en viss potensiell forskjell. For bruk i elektriske apparater kombineres de til batterier.
2. Spesifikk kapasitet
I en viss tid (i timer) kan en kjemisk strømkilde generere en begrenset mengde strøm (i ampere), som tilskrives en vekt- eller volumenhet.
3. Krafttetthet
Det kjennetegner evnen til en vekt- eller volumenhet fra en kjemisk strømkilde til å generere kraft generert av produktet av spenning med strømstyrke.
4. Driftsvarighet
Denne parameteren kalles også utløpsdatoen.
5. Verdien av selvutladningstrømmer
Disse sideprosessene med elektrokjemiske reaksjoner fører til forbruk av den aktive massen til elementene, forårsaker korrosjon og reduserer den spesifikke kapasiteten.
6. Produktpris
Avhengig av design, materialer som er brukt og en rekke andre faktorer.
De beste kjemiske strømkildene er de med høye verdier på de fire første parametrene, og selvutladning og kostnader er lave.
Prinsipper for batteriladning
Blant sekundære kjemiske strømkilder får de stor popularitet. litiumion-modeller, som har blitt mye brukt til å drive elektroniske enheter. De bruker LiMO2 (M Co, Ni, Mn) som materialet til den positive elektroden, og grafitt som det negative.
Ved ladning frigjøres litiumioner fra den påførte eksterne energien fra katodemetallet, passerer gjennom elektrolytten og trenger inn i rommet mellom grafittlagene og akkumuleres der.
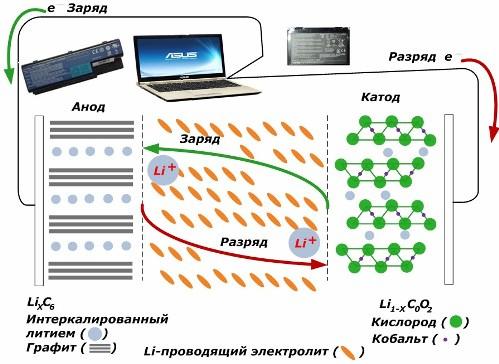
Når energien lader er fraværende, og lasten er koblet til elektrodene, deretter beveger litiumioner i elektrolytten seg i motsatt retning.
Hvis ladingen og utladningen ikke utføres, forbruker ikke energien i batteriet, men lagres. Men mengden er begrenset av egenskapene til materialene som brukes. For eksempel i litium-ion-batterier er den spesifikke elektriske kapasiteten 130 ÷ 150 mAh / g. Det er begrenset av egenskapene til anodematerialet. For grafitt er kapasiteten omtrent to ganger høyere.
Forskere leter nå etter måter å øke batterikapasiteten på, undersøker muligheten for å bruke en kjemisk reaksjon mellom litium og oksygen i luften. For å gjøre dette er design utviklet med en luftkatode som ikke kan brukes, i separate batterier. Denne metoden kan øke energitettheten opp til 10 ganger.
Drift av kjemiske strømkilder krever kunnskap grunnleggende elementer i elektroteknikk, elektrokjemi, materialvitenskap og solid state fysikk.
Se også på elektrohomepro.com
:
