kategorier: Utvalgte artikler » Begynnerelektrikere
Antall visninger: 70526
Kommentarer til artikkelen: 0
Galvaniske celler - enhet, driftsprinsipp, typer og hovedegenskaper
Forutsetninger for utseendet til galvaniske celler. Litt historie. I 1786 oppdaget den italienske professor i medisin, fysiolog Luigi Aloisio Galvani et interessant fenomen: musklene på bakbenene i et nyåpnet liket av en frosk hengt opp på kobberhaker trakk seg sammen da forskeren berørte dem med en stål skalpell. Galvani konkluderte umiddelbart med at dette var en manifestasjon av "animalsk strøm."
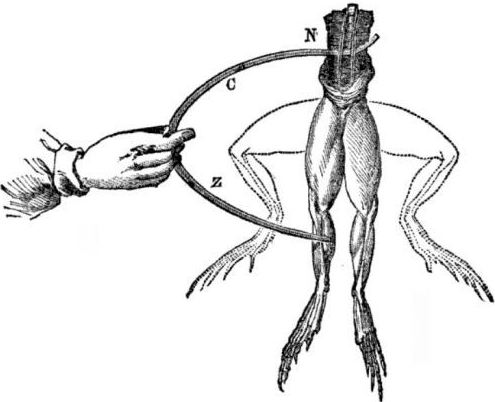
Etter Galvanis død vil hans samtidige Alessandro Volta som kjemiker og fysiker beskrive og offentlig demonstrere en mer realistisk mekanisme for forekomst av elektrisk strøm når forskjellige metaller kommer i kontakt.
Etter en serie eksperimenter vil Volta komme til den entydige konklusjonen at strømmen vises i kretsløpet på grunn av tilstedeværelsen i to ledere av forskjellige metaller plassert i en væske, og dette er overhode ikke "animalsk strøm", som Galvani trodde. Rykningene i froskens ben var en konsekvens av virkningen av strømmen som oppsto ved kontakt av forskjellige metaller (kobberkroker og en stål skalpell).
Volta vil vise de samme fenomenene som Galvani viste på en død frosk, men på et helt livløst hjemmelaget elektrometer, og i 1800 vil gi en nøyaktig forklaring av strømmen: “den andre klassens leder (væske) er i midten og er i kontakt med to førsteklassede ledere av to forskjellige metaller ... Som et resultat av dette oppstår en elektrisk strøm i en eller annen retning. "

I et av de første eksperimentene senket Volta to plater - sink og kobber - i en krukke med syre og koblet dem med ledning. Etter dette begynte sinkplaten å løse seg opp, og det dannet seg gassbobler på kobberstålet. Volta antydet og beviste at elektrisk strøm strømmer gjennom ledningen.
Dermed ble oppfunnet "Volta-elementet" - den første galvaniske cellen. For enkelhets skyld ga Volta ham formen som en vertikal sylinder (søyle), bestående av sammenkoblede ringer av sink, kobber og klut impregnert med syre. En voltpol på en halv meter høy skapte en spenning som er følsom for mennesker.
Siden begynnelsen av forskningen ble lagt av Luigi Galvani, navnet kjemisk strømkilde bevart minnet om ham i hans navn.
Galvanisk celle Er en kjemisk kilde til elektrisk strøm, basert på samspillet mellom to metaller og / eller deres oksider i en elektrolytt, noe som fører til utseendet av en elektrisk strøm i en lukket krets. I galvaniske celler omdannes kjemisk energi til elektrisk energi.
Celler i dag

Celler i dag kalles batterier. Tre typer batterier er utbredt: saltvann (tørt), alkalisk (de kalles også alkalisk, "alkalisk" i oversettelse fra engelsk - "alkalisk") og litium. Prinsippet for deres arbeid er det samme som beskrevet av Volta i 1800: to metaller samhandle gjennom elektrolytt, og en elektrisk strøm oppstår i en ekstern lukket krets.
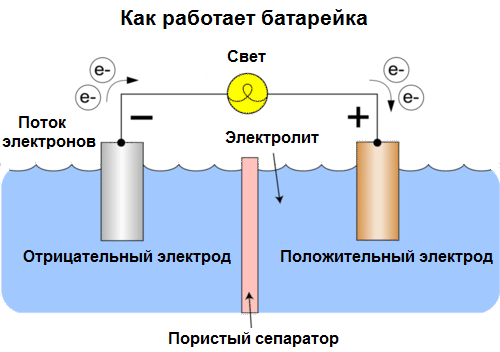
Batterispenning avhenger av metaller som brukes, og av antall celler i "batteriet". I motsetning til batterier er batterier ikke i stand til å gjenopprette egenskapene, siden de direkte konverterer kjemisk energi, det vil si energien fra reagensene (reduksjonsmiddel og oksidasjonsmiddel) som utgjør batteriet, til elektrisk energi.
Reagensene som er inkludert i batteriet forbrukes under drift, strømmen avtar gradvis, derfor avslutter virkningen av kilden etter at reagensene har reagert fullstendig.
Alkaliske og saltelementer (batterier) er mye brukt til å drive en rekke elektroniske enheter, radioutstyr, leker og litium kan ofte finnes i bærbare medisinske apparater som blodsukkermåler eller i digital teknologi som kameraer.

Saltbatterier
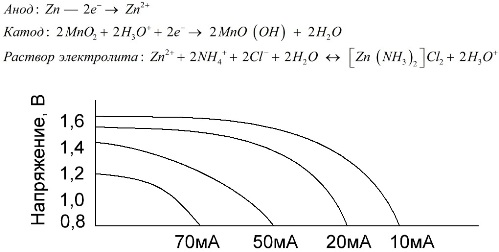
Mangan-sinkceller, som kalles saltbatterier, er "tørre" galvaniske celler, som det ikke er flytende elektrolyttoppløsning i.
En sinkelektrode (+) er en koppformet katode, og en pulveraktig blanding av mangandioksyd og grafitt tjener som anode. Strøm flyter gjennom en grafittstav. Som en elektrolytt brukes en pasta fra en løsning av ammoniumklorid med tilsetning av stivelse eller mel for å tykne, slik at ingenting flyter.
Typisk angir ikke batteriprodusenter den nøyaktige sammensetningen av saltelementene, men saltbatterier er imidlertid de billigste, de brukes vanligvis på enheter der strømforbruket er ekstremt lavt: i timer, i fjernkontroller, i elektroniske termometre, etc.

Konseptet "nominell kapasitet" brukes sjelden for å karakterisere mangan-sink-batterier, siden deres kapasitet er svært avhengig av driftsforhold og -forhold. Hovedulempene ved disse elementene er en betydelig spenningsreduksjonshastighet gjennom hele utladningen og en betydelig reduksjon i utgangskapasiteten med økende utladningsstrøm. Den endelige utladningsspenningen stilles inn avhengig av belastningen i området 0,7-1,0 V.
Det er viktig ikke bare størrelsen på utladningsstrømmen, men også tidsplanen for lasten. Ved periodisk utladning av store og mellomstore strømmer øker ytelsen til batteriene markant sammenlignet med kontinuerlig drift. Imidlertid, med små utladningsstrømmer og måneder med avbrudd i drift, kan kapasitansen deres reduseres som et resultat av selvutladning.
Grafen over viser utladningskurvene for et gjennomsnittlig saltbatteri i 4, 10, 20 og 40 timer for sammenligning med en alkalisk en, som vil bli diskutert senere.
Alkaliske (alkaliske) batterier
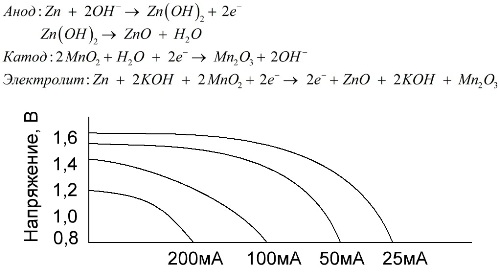
Et alkalisk batteri er et galvanisk mangan-sink-batteri, der mangandioksid brukes som katode, pulverisert sink brukes som anode, og en alkaliløsning brukes som en elektrolytt, vanligvis i form av en kaliumhydroksydpasta.
Disse batteriene har en rekke fordeler (spesielt en betydelig større kapasitet, bedre ytelse ved lave temperaturer og høye belastningsstrømmer).

Sammenlignet med saltvann kan alkaliske batterier gi mer strøm i lang tid. En større strøm blir mulig fordi sink her ikke brukes i form av et glass, men i form av et pulver som har et større kontaktområde med elektrolytten. Kaliumhydroksyd i form av en pasta brukes som elektrolytt.
Det er takket være evnen til denne typen galvaniske celler til å levere en betydelig strøm (opptil 1 A) i lang tid, er alkaliske batterier vanligst for tiden.
I elektriske leker, i bærbart medisinsk utstyr, i elektroniske apparater, i kameraer, brukes alkaliske batterier overalt. De tjener 1,5 ganger lenger enn saltvann hvis utslippet er lite strøm. Grafen viser utladningskurvene ved forskjellige strømmer for sammenligning med et saltbatteri (grafen ble gitt ovenfor) i 4, 10, 20 og 40 timer.
Litiumbatterier
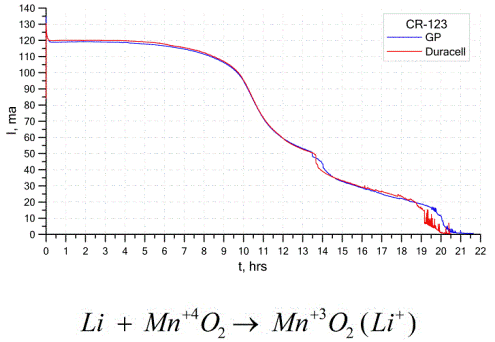
En annen ganske vanlig type galvaniske celler er litiumbatterier - enkle ikke-ladbare galvaniske celler der litium eller forbindelser blir brukt som anode. På grunn av bruken av alkalimetall har de en stor potensiell forskjell.

Katoden og elektrolytten til en litiumcelle kan være veldig forskjellig, så uttrykket "litiumcelle" kombinerer en gruppe celler med det samme anodematerialet.Som en katode kan for eksempel mangandioksyd, karbonmonofluorid, pyritt, tionylklorid, etc. anvendes.
Litiumbatterier skiller seg fra andre batterier av deres høye driftstid og høye kostnader. Avhengig av størrelsen og kjemiske materialer som brukes, kan et litiumbatteri produsere spenninger fra 1,5 V (kompatibel med alkaliske batterier) til 3,7 V.
Disse batteriene har den høyeste kapasiteten per masseenhet og lang holdbarhet. Litiumceller er mye brukt i moderne bærbart elektronisk utstyr: for å drive klokker på datamaskinens hovedkort, for å drive bærbare medisinske apparater, klokker, kalkulatorer, i fotografisk utstyr, etc.
Grafen over viser utladningskurvene for to litiumbatterier fra to populære produsenter. Den innledende strømmen var 120 mA (per motstand i størrelsesorden 24 ohm).
Se også på elektrohomepro.com
: